



業(yè)務(wù)咨詢
中國(guó):
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





圖片來(lái)源:國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心

圖片來(lái)源:國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心
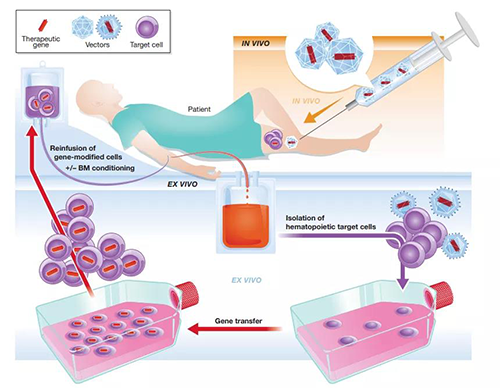
體內(nèi)和離體基因治療[2]
[1] T Friedmann. A brief history of gene therapy. Nat Genet. 1992 Oct;2(2):93-8.
[2] Kerstin B Kaufmann, et al. Gene therapy on the move. EMBO Mol Med. 2013 Nov;5(11):1642-61.
[3] Luigi Naldini. Gene therapy returns to centre stage. Nature. 2015 Oct 15;526(7573):351-60.
[4] Stuart H Orkin, et al. Emerging GeneticTherapy for Sickle Cell Disease. Annu Rev Med.2019 Jan 27;70:257-271.
[5] Vivek Sudhakar, et al. Gene Therapy forNeurodegenerative Diseases. Neurotherapeutics. 2019 Jan;16(1):166-175.
[6] Don P Wolf, et al. Principles ofand strategies for germline gene therapy. Nat Med. 2019Jun;25(6):890-897.
[7] Alain Fischer,et al. Genetherapy for severe combined immunodeficiencies and beyond. J Exp Med. 2020 Jan 6;217(2):e20190607.

歡迎掃碼入群
了解更多美迪西研發(fā)和技術(shù)平臺(tái)

或添加美迪西市場(chǎng)部微信名片
 相關(guān)新聞
相關(guān)新聞